近日,我校无涯创新学院孙进教授和孙丙军教授课题组在硫属杂化键桥连的同型二聚体前药自组装纳米递送领域取得新进展。课题组使用碲原子(Te)或硒原子(Se)替换三硫键(-SSS-)中的中间硫原子,构建了氧化还原双敏感的硫碲硫键(-STeS-)和硫硒硫键(-SSeS-)桥连的同型二聚体前药。课题组研究发现,硫属杂化键的引入能够克服同型二聚体前药纳米组装体(HPNAs)组装稳定性差和靶点激活不足的两个固有局限。该项研究成果以“Hybrid chalcogen bonds in prodrug nanoassemblies provides dual redox-responsivity in the tumor microenvironment”为题在线发表于Nature系列子刊NatureCommunications(IF17.694,DOI:10.1038/s41467-022-35033-7)。
同型二聚体前药自组装纳米递送系统
利用合适的连接链,将两个药物分子偶联,可以在不借助载体的情况下自组装形成HPNAs。与脂质体和胶束等传统纳米制剂相比,HPNAs具有载药量高和载体相关毒性低的优势,有望成为一种高效-低毒型药物递送平台。然而,自组装能力弱和靶点激活不足限制了HPNAs的应用,合理设计具有良好自组装稳定性和肿瘤选择性激活的HPNAs仍然是一个巨大的挑战。
含硫连接链增强同型二聚体前药组装能力
课题组在前期工作中发现硫键具有接近90°的键角,可以引入“结构缺陷”以防止前药分子的过度聚集,促进纳米组装体的形成(Science Advances, 2020,6(45): eabc1725;Nano Today, 2022, 44:101480)。与单硫键和二硫键相比,三硫键由更多的硫原子和含硫键角组成。因此,三硫键可以有效地提高HPNAs的自组装稳定性,并表现出超高的还原敏感性,可以响应肿瘤细胞中高水平的谷胱甘肽。然而,三硫键的氧化敏感性远远弱于其还原敏感性。由于肿瘤组织呈现出异质性的氧化还原微环境,因此需要构建一种对肿瘤氧化还原异质性具有超高双重敏感性的新型药物递送系统。
将硫属杂化键引入二聚体前药纳米组装体
在元素周期表中,碲、硒与硫同属于VI主族,也称为硫属元素。与硫相比,碲和硒具有更高的氧化响应潜力。此外,课题组在前期工作中发现,硒键的键角和二面角比硫键更接近90°,有利于促进前药的自组装(Nature Communications, 2019, 10:3211)。由此,课题组提出将硫碲硫(-STeS-)和硫硒硫(-SSeS-)两种硫属杂合键引入二聚体前药纳米组装体的设想。与三硫键(-SSS-)和硫碳硫键(-SCS-)相比,硫属杂化键通过提供强的分子间作用力和足够的空间位阻有效提高了HPNAs的自组装稳定性和肿瘤蓄积能力。更重要的是,硫碲硫键桥连的HPNAs对氧化和还原环境均表现出超高的双重敏感性,可以有效响应异质性肿瘤微环境。
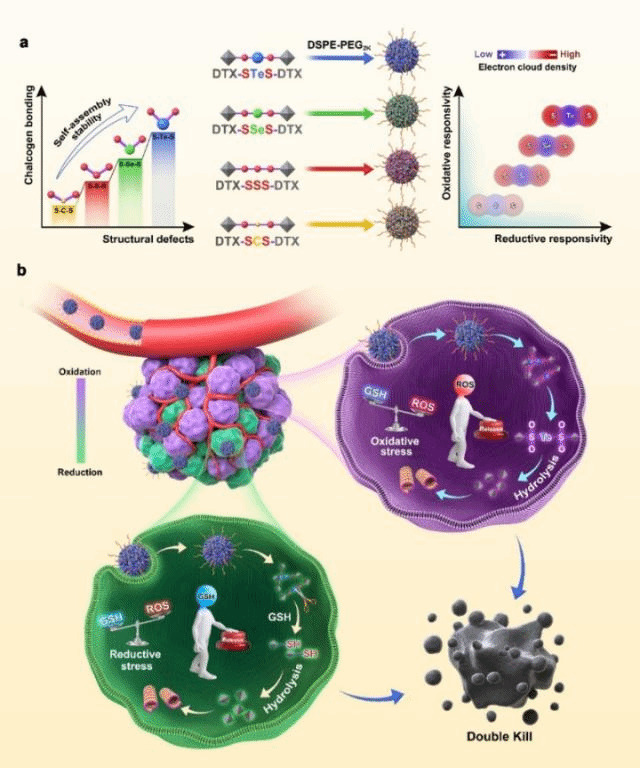
图1.同型二聚体前药纳米组装体的构建及硫碲硫前药纳米组装体氧化还原双重激活
该研究由我校独立完成,博士研究生刘钿为论文第一作者,无涯创新学院孙进教授和孙丙军教授为共同通讯作者。该研究得到了何仲贵教授的指导与支持,还获得了国家重点研发计划政府间合作项目、国家自然科学基金项目,辽宁省博士科研启动基金计划项目和辽宁省教育厅面上项目的资助。
原文链接:https://www.nature.com/articles/s41467-022-35033-7