沈阳药科大学药学院王思玲教授研究团队在难溶性药物的口服淋巴靶向递送方面取得重要进展,相关科研成果“Chylomicron-pretended nano-bio self-assembling vehicle to promote T lymphatic transport and GALTs target of oral drugs”发表于国际纳米材料领域权威期刊Biomaterials(2019, 188: 173-186,IF:10.317);相关新型仿生药物载体用于流感疫苗肠淋巴转运与免疫新机制的深入探索研究得到国家自然科学基金的资助(No.82073798, 2021-2024)。
肠淋巴转运途径,可避开血液途径必经的肝脏首过代谢环节,提高口服药物的生物利用度;同时,肠淋巴转运途径增加了药物在肠淋巴系统中的浓度,可靶向治疗某些进展过程与淋巴密切相关的疾病,如自身免疫疾病、淋巴瘤等。因此,深入探索肠淋巴转运的新机制,设计新型肠淋巴靶向药物递送系统,必将有助于提高口服药物的生物利用度,为经口服给药途径治疗多种恶性疾病带来新希望。
洛匹那韦,作为一种高效艾滋病病毒逆转录酶抑制剂,其溶解性差与严重的首过效应,致使口服生物利用度较低。且口服后药物的脱靶分布,使得艾滋病病毒贮存组织——肠系膜淋巴系统内的药物浓度难以达到有效的治疗浓度。这些缺点严重限制了此类药物的临床疗效。因此,亟需解决口服难溶性抗艾滋病药物如洛匹那韦等由于难溶性与首过代谢导致的生物利用度低的问题,同时应提高肠淋巴系统内的药物浓度,使艾滋病的治疗做到高效且低毒。
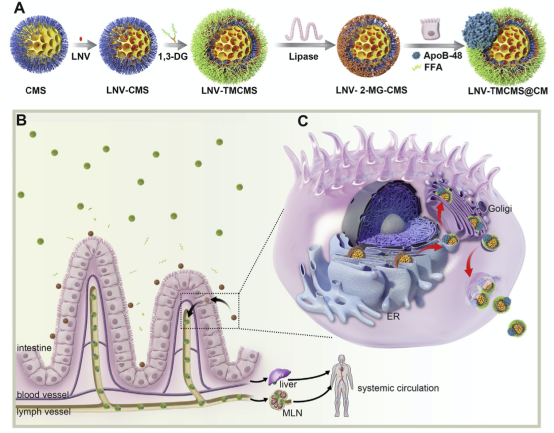
基于以上科学问题,王思玲教授研究团队借鉴食物中的脂肪(即甘油三酯,Triglyceride,TG)于小肠上皮细胞进入肠淋巴组织的行为,探索性提出构建新型仿生口服药物递送系统。研究在以胶态介孔硅(Colloidal Mesoporous Silica,CMS)为核心纳米骨架载体,解决难溶性药物的高效装载与稳定分散,通过共价连接1,3-二棕榈酸单甘油酯(1, 3-Diacylglycerol,1,3-DG)于CMS表面,获得具有甘油三酯类似结构的纳米载体(TMCMS)。
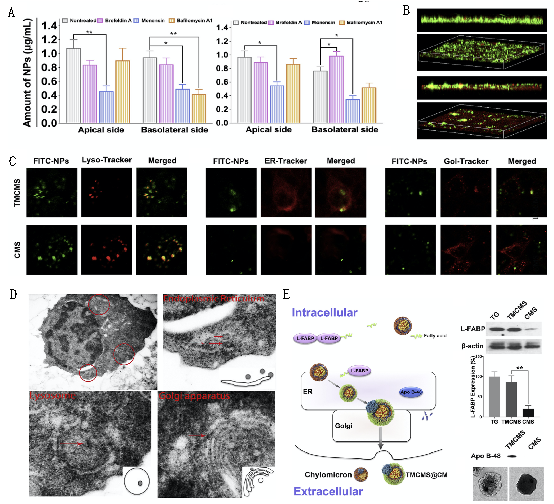
研究证实TMCMS可模拟食物脂肪的肠吸收行为,参与肠上皮细胞内乳糜微粒合成过程,经肠上皮细胞膜上的小窝蛋白与网格蛋白转运入胞,于粗面内质网与高尔基体网腔内与乳糜微粒标志性蛋白(ApoB48)结合,形成乳糜微粒仿生结构(TMCMS@CM)外排出胞,携带药物分子转运至肠系膜淋巴系统,从而显著地提高了难溶性药物的口服生物利用度,为口服LNV的10.6倍,并显著提高洛匹那韦在肠系膜淋巴结内的蓄积量,为口服洛匹那韦的4.7倍。
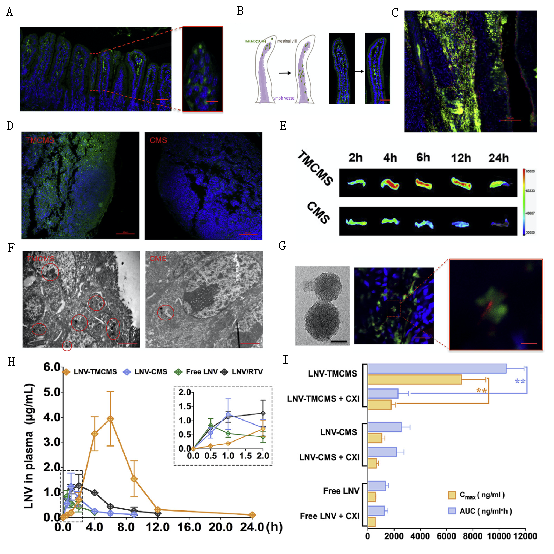
王思玲教授研究团队揭示的新型仿生药物载体肠淋巴转运机制,为经肠上皮细胞进入肠淋巴组织途径的口服药物递送系统的设计,提供了创新性的探索思路,将对突破难溶性药物口服生物利用度低的科学难题具有重要的引领意义。